अम्ल, क्षार और लवण
प्रैक्टिस प्रश्न सेट 1
प्रश्न 1: आपको तीन परीक्षण ट्यूब दिए गए हैं। उनमें से एक में आसुत जल है और अन्य दो में एक अम्लीय विलयन और एक क्षारीय विलयन है। यदि आपको केवल लाल लिटमस कागज दिया गया हो, तो आप प्रत्येक परीक्षण ट्यूब की सामग्री को कैसे पहचानेंगे?
उत्तर:
यदि लाल लिटमस कागज का रंग नीला हो जाता है, तो वह एक क्षार है और यदि रंग में कोई बदलाव नहीं होता है, तो वह अम्लीय या तटस्थ हो सकता है। इस प्रकार, क्षारीय विलयन को आसानी से पहचाना जा सकता है।
हम तीन परीक्षण ट्यूबों को A, B और C के रूप में चिह्नित करते हैं। A के विलयन की एक बूँद लाल लिटमस कागज पर डाली जाती है। इसी प्रक्रिया को B और C के विलयनों के साथ भी दोहराया जाता है। यदि इनमें से कोई भी रंग बदल कर नीला हो जाता है, तो वह क्षारीय है। इस प्रकार, तीनों में से एक को हटा दिया जाता है।
बचे हुए दो में से, कोई एक अम्लीय या तटस्थ हो सकता है। अब, किसी एक क्षारीय विलयन की एक बूँद प्रत्येक शेष विलयन में अलग-अलग मिलाई जाती है और फिर मिश्रण की बूँदों के प्रकार की जाँच की जाती है। यदि लाल लिटमस का रंग नीला हो जाता है, तो दूसरा विलयन तटस्थ है, और यदि रंग में कोई बदलाव नहीं होता है, तो दूसरा विलयन अम्लीय है। ऐसा इसलिए क्योंकि अम्लीय और क्षारीय विलयन आपस में न्यूट्रलाइज़ करते हैं। इस प्रकार, हम तीन प्रकार के विलयनों में अंतर कर सकते हैं।
प्रश्न 2: जब एक अम्ल धातु के साथ प्रतिक्रिया करता है, तो सामान्यत: कौन सा गैस उत्पन्न होता है? एक उदाहरण से स्पष्ट करें। इस गैस की उपस्थिति का परीक्षण कैसे करेंगे?
उत्तर:
जब एक अम्ल धातु के साथ प्रतिक्रिया करता है, तो सामान्यत: हाइड्रोजन गैस उत्पन्न होती है।
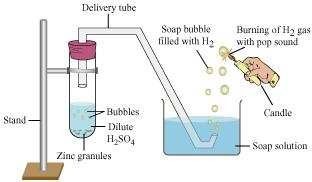
कुछ जिंक के दानों को लेकर उसमें 5 मिलीलीटर पतला H2SO4 डाला जाता है। इसे हिलाएं और उत्पन्न गैस को साबुन के घोल में पास करें। साबुन के घोल में बुलबुले बनते हैं। इन बुलबुलों में हाइड्रोजन गैस होती है।
हम उत्पन्न हाइड्रोजन गैस का परीक्षण एक बत्ति के पास लाकर कर सकते हैं, जहां गैस जलने पर एक ‘पॉप’ ध्वनि उत्पन्न होगी।
प्रश्न 3: धातु यौगिक A, पतला हाइड्रोक्लोरिक अम्ल के साथ प्रतिक्रिया करता है और उबाला उत्पन्न होता है। उत्पन्न गैस जलती हुई मोमबत्ती को बुझा देती है। यदि इस प्रतिक्रिया में एक यौगिक कैल्शियम क्लोराइड बनता है, तो रासायनिक समीकरण लिखिए।
उत्तर:
यह प्रतिक्रिया कैल्शियम कार्बोनेट के हाइड्रोक्लोरिक अम्ल के साथ प्रतिक्रिया करने पर कार्बन डाइऑक्साइड गैस के उत्सर्जन की है (जो जलती हुई मोमबत्ती को बुझा देती है)।
इस प्रतिक्रिया का संतुलित रासायनिक समीकरण इस प्रकार है:
CaCO3 (s) + 2HCl (aq) → CaCl2 (aq) + H2O (l) + CO2 (g)
प्रैक्टिस प्रश्न सेट 2
प्रश्न 1: HCl, HNO3 आदि जल विलयनों में अम्लीय गुण क्यों दिखाते हैं जबकि अल्कोहल और ग्लूकोज जैसे यौगिकों के विलयन अम्लीय गुण नहीं दिखाते?
उत्तर:
HCl या HNO3 का विघटन जल के उपस्थित होने पर हमेशा हाइड्रोजन आयन (H+) बनाने के लिए होता है। हाइड्रोजन आयन (H+) जल के साथ मिलकर हाइड्रोनियम आयन (H3O+) बनाते हैं।
यह प्रतिक्रिया इस प्रकार है:
HCl (aq) → H3O+ (aq) + Cl− (aq)
हालांकि, ग्लूकोज और अल्कोहल के जल विलयन में हाइड्रोजन होता है, ये जल में हाइड्रोजन आयन बनाने के लिए विघटित नहीं होते। इसलिए, ये अम्लीय गुण नहीं दिखाते।
प्रश्न 2: अम्लीय विलयन विद्युत क्यों संचालित करते हैं?
उत्तर:
अम्लीय विलयन में आयन उत्पन्न होते हैं। ये आयन विद्युत संचलन के लिए जिम्मेदार होते हैं।
प्रश्न 3: सूखा HCl गैस सूखे लिटमस कागज का रंग क्यों नहीं बदलता?
उत्तर:
लिटमस कागज का रंग हाइड्रोजन आयन के द्वारा बदलता है। सूखा HCl गैस में H+ आयन नहीं होते। केवल जल विलयन में ही एक अम्ल आयनों में विघटित होता है। चूंकि इस मामले में न तो HCl जल रूप में है और न ही लिटमस कागज गीला है, इसलिए लिटमस कागज का रंग नहीं बदलता।
प्रश्न 4: जब किसी अम्ल को पतला किया जाता है, तो क्यों यह अनुशंसा की जाती है कि अम्ल को पानी में डाला जाए और पानी को अम्ल में नहीं?
उत्तर:
चूंकि अम्ल को पानी में घोलने की प्रक्रिया उत्सर्जक (exothermic) होती है, इसलिए हमेशा यह अनुशंसा की जाती है कि अम्ल को पानी में डाला जाए। यदि इसे उल्टा किया जाता है, तो यह संभव है कि:
उत्सर्जित होने वाली अधिक मात्रा में गर्मी के कारण मिश्रण उछल सकता है और जलन पैदा कर सकता है।
प्रश्न 5: जब किसी अम्ल का विलयन पतला किया जाता है, तो हाइड्रोनियम आयनों (H3O+) की सांद्रता पर क्या प्रभाव पड़ता है?
उत्तर:
जब किसी अम्ल का विलयन पतला किया जाता है, तो हाइड्रोनियम आयनों (H3O+) की सांद्रता प्रति इकाई मात्रा घट जाती है। इसका मतलब है कि अम्ल की ताकत घट जाती है।
प्रश्न 6: जब अधिक क्षार को सोडियम हाइड्रॉक्साइड के विलयन में घोला जाता है, तो हाइड्रॉक्साइड आयनों (OH−) की सांद्रता पर क्या प्रभाव पड़ता है?
उत्तर:
जब अधिक क्षार को सोडियम हाइड्रॉक्साइड के विलयन में घोला जाता है, तो हाइड्रॉक्साइड आयनों (OH−) की सांद्रता बढ़ जाती है।
प्रैक्टिस प्रश्न सेट 3
प्रश्न 1: आपके पास दो विलयन हैं, A और B। विलयन A का pH 6 है और विलयन B का pH 8 है। किस विलयन में अधिक हाइड्रोजन आयन की सांद्रता है? इनमें से कौन सा अम्लीय है और कौन सा क्षारीय है?
उत्तर:
pH का मान 7 से कम होने पर विलयन अम्लीय होता है, जबकि 7 से अधिक होने पर विलयन क्षारीय होता है। इसलिए, pH = 6 वाला विलयन अम्लीय है और इसमें pH = 8 वाले विलयन की तुलना में अधिक हाइड्रोजन आयन की सांद्रता है, जो क्षारीय है।
प्रश्न 2: आयनों की सांद्रता विलयन के गुण पर क्या प्रभाव डालती है?
उत्तर:
H+ आयनों की सांद्रता विलयन के गुण पर विभिन्न प्रभाव डाल सकती है। जैसे-जैसे H+ आयन की सांद्रता बढ़ती है, विलयन अधिक अम्लीय हो जाता है, जबकि H+ आयन की सांद्रता घटने पर विलयन की क्षारीयता बढ़ जाती है।
प्रश्न 3: क्या क्षारीय विलयन में भी H+ आयन होते हैं? यदि हां, तो वे क्षारीय क्यों होते हैं?
उत्तर:
हां, क्षारीय विलयन में भी H+ आयन होते हैं। हालांकि, इन आयनों की सांद्रता OH− आयनों की तुलना में कम होती है, जिसके कारण विलयन क्षारीय होता है।
प्रश्न 4: किस मिट्टी की स्थिति में आपको लगता है कि एक किसान अपने खेतों की मिट्टी को क्विक चूना (कैल्शियम ऑक्साइड) या स्लैक चूना (कैल्शियम हाइड्रॉक्साइड) या चाक (कैल्शियम कार्बोनेट) से उपचार करेगा?
उत्तर:
यदि मिट्टी अम्लीय है और खेती के लिए उपयुक्त नहीं है, तो मिट्टी की क्षारीयता बढ़ाने के लिए किसान क्विक चूना, स्लैक चूना या चाक से मिट्टी का उपचार करेगा।
प्रैक्टिस प्रश्न सेट 4
प्रश्न 1: यौगिक CaOCl2 का सामान्य नाम क्या है?
उत्तर:
यौगिक CaOCl2 का सामान्य नाम ब्लीचिंग पाउडर है।
प्रश्न 2: वह पदार्थ क्या है जो क्लोरीन के साथ उपचार करने पर ब्लीचिंग पाउडर उत्पन्न करता है?
उत्तर:
कैल्शियम हाइड्रॉक्साइड [Ca(OH)2] क्लोरीन के साथ उपचार करने पर ब्लीचिंग पाउडर उत्पन्न करता है।
प्रश्न 3: वह सोडियम यौगिक कौन सा है जिसे कठोर जल को नरम करने के लिए उपयोग किया जाता है?
उत्तर:
वॉशिंग सोडा (Na2CO3.10H2O) कठोर जल को नरम करने के लिए उपयोग किया जाता है।
प्रश्न 4: यदि सोडियम हाइड्रोकार्बोनेट के विलयन को गरम किया जाए तो क्या होगा? संबंधित प्रतिक्रिया का समीकरण दें।
उत्तर:
जब सोडियम हाइड्रोकार्बोनेट (सोडियम हाइड्रोजनकार्बोनेट) के विलयन को गरम किया जाता है, तो सोडियम कार्बोनेट और पानी उत्पन्न होते हैं, साथ ही कार्बन डाइऑक्साइड गैस का उत्सर्जन होता है।
2NaHCO3 → Na2CO3 + H2O + CO2
प्रश्न 5: प्लास्टर ऑफ पेरिस और पानी के बीच प्रतिक्रिया को दिखाने वाला समीकरण लिखें।
उत्तर:
प्लास्टर ऑफ पेरिस और पानी के बीच प्रतिक्रिया का रासायनिक समीकरण इस प्रकार है:
CaSO4.1/2H2O + 1/2 H2O → CaSO4.2H2O
अभ्यास प्रश्न
प्रश्न 1: एक विलयन लाल लिटमस को नीला कर देता है, इसका pH संभावना से क्या होगा?
उत्तर:
(d) क्षार लाल लिटमस को नीला कर देते हैं और अम्ल नीले लिटमस को लाल कर देते हैं। क्षारीय विलयन का pH मान 7 से अधिक होता है। चूंकि यह विलयन लाल लिटमस को नीला कर देता है, इसका pH संभावना से 10 होगा।
प्रश्न 2: एक विलयन क्रश किए हुए अंडे के छिलकों से प्रतिक्रिया करता है और एक गैस उत्पन्न करता है जो चूने के पानी को दूधिया बना देती है। उस विलयन में क्या है?
उत्तर:
(b) उस विलयन में HCl है।
प्रश्न 3: 10 मL NaOH के विलयन को 8 मL HCl के विलयन द्वारा पूरी तरह से न्यूट्रलाइज़ किया गया है। यदि हम 20 मL उसी NaOH के विलयन का उपयोग करें, तो उसे न्यूट्रलाइज़ करने के लिए HCl विलयन की मात्रा (वही विलयन जैसा पहले था) कितनी होगी?
उत्तर:
(d) 16 mL HCl विलयन की आवश्यकता होगी।
प्रश्न 4: निम्नलिखित में से कौन से प्रकार की दवाइयाँ अम्लपित्त के उपचार के लिए उपयोग की जाती हैं?
उत्तर:
(c) एंटीऐसिड का उपयोग अम्लपित्त के उपचार के लिए किया जाता है।
प्रश्न 5: शब्द समीकरण लिखें और फिर संतुलित समीकरण लिखें जब −
(a) पतला सल्फ्यूरिक अम्ल जस्ता के दानों के साथ प्रतिक्रिया करता है।
शब्द समीकरण: सल्फ्यूरिक अम्ल + जस्ता → जस्ता सल्फेट + हाइड्रोजन
H2SO4 + Zn → ZnSO4 + H2
(b) पतला हाइड्रोक्लोरिक अम्ल मैग्नीशियम रिबन के साथ प्रतिक्रिया करता है।
शब्द समीकरण: हाइड्रोक्लोरिक अम्ल + मैग्नीशियम → मैग्नीशियम क्लोराइड + हाइड्रोजन
2HCl + Mg → MgCl2 + H2
(c) पतला सल्फ्यूरिक अम्ल एल्यूमिनियम पाउडर के साथ प्रतिक्रिया करता है।
शब्द समीकरण: सल्फ्यूरिक अम्ल + एल्यूमिनियम → एल्यूमिनियम सल्फेट + हाइड्रोजन
3H2SO4 + 2Al → Al2(SO4)3 + 3H2
(d) पतला हाइड्रोक्लोरिक अम्ल लोहे के फिलिंग्स के साथ प्रतिक्रिया करता है।
शब्द समीकरण: हाइड्रोक्लोरिक अम्ल + लोहा → फेरिक क्लोराइड + हाइड्रोजन
6HCl + 2Fe → 2FeCl3 + 3H2
प्रश्न 6: यौगिक जैसे शराब और ग्लूकोज भी हाइड्रोजन contain करते हैं लेकिन इन्हें अम्ल के रूप में वर्गीकृत नहीं किया जाता। इसे साबित करने के लिए एक गतिविधि का वर्णन करें।
उत्तर:
दो नाखूनों को एक कॉर्क में फिट किया जाता है और इन्हें एक 6 वोल्ट बैटरी के दो टर्मिनलों से जोड़ दिया जाता है, साथ ही एक बल्ब और स्विच भी जुड़ा होता है। कुछ पतला HCl बीकर में डाला जाता है और करंट चालू किया जाता है। फिर वही प्रयोग ग्लूकोज विलयन और शराब विलयन के साथ किया जाता है।
पर्यवेक्षाएँ: यह देखा जाएगा कि HCl विलयन में बल्ब जलता है और ग्लूकोज विलयन में नहीं जलता।
परिणाम: HCl H+ और Cl− आयनों में विभाजित होता है। ये आयन विलयन में विद्युत् प्रवाह को सक्षम बनाते हैं, जिससे बल्ब जलता है। दूसरी ओर, ग्लूकोज विलयन आयनों में विभाजित नहीं होता है, इसलिये यह विद्युत् का संचालन नहीं करता।
निष्कर्ष: इस गतिविधि से यह निष्कर्ष निकाला जा सकता है कि सभी अम्लों में हाइड्रोजन होता है, लेकिन सभी हाइड्रोजन containing यौगिकों को अम्ल के रूप में वर्गीकृत नहीं किया जाता। यही कारण है कि, यद्यपि शराब और ग्लूकोज में हाइड्रोजन होता है, वे अम्ल के रूप में वर्गीकृत नहीं होते।
प्रश्न 7: क्यों आसुत पानी विद्युत का संचालन नहीं करता, जबकि वर्षा का पानी करता है?
उत्तर:
आसुत पानी पानी का शुद्ध रूप होता है और इसमें कोई आयनिक प्रजातियाँ नहीं होती हैं। इसलिए यह विद्युत का संचालन नहीं करता। वर्षा का पानी, जो पानी का अशुद्ध रूप है, में बहुत सी आयनिक प्रजातियाँ होती हैं जैसे अम्ल, और इस कारण यह विद्युत का संचालन करता है।
प्रश्न 8: क्यों अम्ल पानी के बिना अम्लीय व्यवहार नहीं दिखाते हैं?
उत्तर:
अम्ल पानी के बिना अम्लीय व्यवहार नहीं दिखाते क्योंकि अम्ल से हाइड्रोजन आयनों का विसंघन (dissociation) केवल पानी की उपस्थिति में ही होता है। हाइड्रोजन आयन ही अम्लीय व्यवहार के लिए जिम्मेदार होते हैं।
प्रश्न 9: पाँच विलयन A, B, C, D और E जब यूनिवर्सल इंडिकेटर से जांचे गए, तो उनका pH क्रमशः 4, 1, 11, 7 और 9 था। इनमें से कौन सा विलयन है:
उत्तर:
(a) न्यूट्रल → विलयन D, जिसका pH 7 है।
(b) बहुत क्षारीय → विलयन C, जिसका pH 11 है।
(c) बहुत अम्लीय → विलयन B, जिसका pH 1 है।
(d) कमजोर अम्लीय → विलयन A, जिसका pH 4 है।
(e) कमजोर क्षारीय → विलयन E, जिसका pH 9 है।
pH को हाइड्रोजन आयनों की सांद्रता के क्रम में इस प्रकार व्यवस्थित किया जा सकता है: 11 < 9 < 7 < 4 < 1
प्रश्न 10: समान लंबाई के मैग्नीशियम रिबन को टेस्ट ट्यूब A और B में लिया गया है। टेस्ट ट्यूब A में हाइड्रोक्लोरिक अम्ल (HCl) डाला गया है, जबकि टेस्ट ट्यूब B में एसीटिक अम्ल (CH3COOH) डाला गया है। किस टेस्ट ट्यूब में अधिक जोर से बुदबुदाहट होगी और क्यों?
उत्तर:
बुदबुदाहट टेस्ट ट्यूब A में अधिक जोर से होगी, जिसमें हाइड्रोक्लोरिक अम्ल (HCl) डाला गया है। ऐसा इसलिए होगा क्योंकि HCl, CH3COOH से अधिक मजबूत अम्ल है और इस कारण यह अधिक तेज़ी से हाइड्रोजन गैस उत्पन्न करता है, जिससे बुदबुदाहट होती है।
प्रश्न 11: ताजे दूध का pH 6 है। आपको क्या लगता है कि जब यह दही में बदलता है तो pH में क्या परिवर्तन होगा? अपना उत्तर स्पष्ट करें।
उत्तर:
दूध का pH 6 है। जब यह दही में बदलता है, तो pH कम हो जाएगा क्योंकि दही स्वाभाविक रूप से अम्लीय होता है। इसमें उपस्थित अम्ल pH को घटा देते हैं।
प्रश्न 12: एक दूधवाला ताजे दूध में बहुत छोटी मात्रा में बेकिंग सोडा डालता है।
(a) वह ताजे दूध का pH 6 से हल्का क्षारीय क्यों बदलता है?
उत्तर:
(a) दूधवाला ताजे दूध का pH 6 से हल्का क्षारीय इसलिए बदलता है क्योंकि क्षारीय अवस्था में दूध आसानी से दही के रूप में नहीं जमता है।
(b) यह दूध दही में सेट होने में लंबा समय क्यों लेता है?
उत्तर:
(b) चूंकि यह दूध सामान्य दूध से थोड़ा अधिक क्षारीय है, दही सेट करने के लिए उत्पन्न होने वाले अम्लों को क्षार द्वारा न्यूट्रलाइज किया जाता है। इसलिए, दही बनने में अधिक समय लगता है।
प्रश्न 13: प्लास्टर ऑफ पेरिस को नमी से बचाकर क्यों रखा जाना चाहिए? इसका कारण स्पष्ट करें।
उत्तर:
प्लास्टर ऑफ पेरिस (POP) को नमी से बचाकर रखा जाना चाहिए क्योंकि प्लास्टर ऑफ पेरिस, एक पाउडरी पदार्थ, पानी (नमी) को अवशोषित करता है और इससे एक कठोर ठोस रूप बनता है, जिसे जिप्सम कहते हैं।
प्रश्न 14: न्यूट्रलाइजेशन प्रतिक्रिया क्या है? इसके दो उदाहरण दें।
उत्तर:
एक प्रतिक्रिया जिसमें एक अम्ल और एक क्षार आपस में प्रतिक्रिया करके एक नमक और पानी उत्पन्न करते हैं, उसे न्यूट्रलाइजेशन प्रतिक्रिया कहते हैं। इस प्रतिक्रिया में ऊष्मा के रूप में ऊर्जा उत्पन्न होती है। उदाहरण के लिए:
- हाइड्रोक्लोरिक अम्ल + सोडियम हाइड्रोक्साइड → सोडियम क्लोराइड + पानी
HCl + NaOH → NaCl + H2O
प्रश्न 15: वॉशिंग सोडा और बेकिंग सोडा के दो महत्वपूर्ण उपयोग दें।
उत्तर:
वॉशिंग सोडा और बेकिंग सोडा के दो महत्वपूर्ण उपयोग निम्नलिखित हैं:
1) वॉशिंग सोडा:
- इसे कांच, साबुन और कागज उद्योगों में उपयोग किया जाता है।
- यह पानी की स्थायी कठोरता को दूर करने के लिए उपयोग किया जाता है।
2) बेकिंग सोडा:
- इसे बेकिंग पाउडर के रूप में उपयोग किया जाता है। बेकिंग पाउडर, बेकिंग सोडा और एक हल्के अम्ल, जिसे टार्टरिक एसिड कहते हैं, का मिश्रण होता है। जब इसे गर्म किया जाता है या पानी में मिलाया जाता है, तो यह CO2 गैस छोड़ता है, जो ब्रेड या केक को फूला हुआ बनाता है।
- इसे सोडा-असिड अग्निशामक यंत्रों में उपयोग किया जाता है।
